În procedurile de augmentare osoasă, regenerarea eficientă a osului depinde de capacitatea mediului local de a susține vascularizarea, recrutarea celulară și remodelarea tisulară pe termen mediu și lung. Materialele utilizate pentru grefa osoasa oferă suport structural și stabilitate volumetrică, însă formarea unui os funcțional este condiționată de interacțiunea dintre schela de grefare și procesele biologice care au loc în fazele timpurii ale vindecării. În acest context, calitatea regenerării este influențată atât de proprietățile materialului utilizat, cât și de răspunsul biologic al țesuturilor gazdă.
PRF a fost descris ca un biomaterial autolog bioactiv, alcătuit dintr-o schelă de fibrină încărcată cu trombocite, leucocite și factori de creștere eliberați progresiv la doze fiziologic relevante. Această structură favorizează angiogeneza și susține migrarea și proliferarea celulelor implicate în osteogeneză, contribuind în același timp la stabilizarea timpurie a țesuturilor. Prin aceste mecanisme, PRF influențează simultan regenerarea osoasă și vindecarea țesuturilor moi, două procese interdependente în cadrul augmentărilor osoase.
Limitările mecanice ale PRF ca material singular au condus la utilizarea sa în asociere cu materiale de adiție de os, în special cu xenogrefe, pentru a crea un micro-mediu biologic mai favorabil regenerării. Integrarea PRF în structura grefei contribuie la îmbunătățirea biocompatibilității, la susținerea vascularizării și la maturarea progresivă a osului nou format. Această abordare explică interesul crescut pentru PRF în strategiile moderne de augmentare osoasă, unde accentul cade pe calitatea regenerării și pe stabilitatea țesuturilor pe termen lung.
PRF în contextul augmentării osoase: principii biologice relevante
În ultimii ani, PRF a fost privit tot mai mult ca un biomaterial autolog cu rol activ în procesele regenerative, tocmai pentru că îmbină două elemente esențiale într-un singur produs: o matrice tridimensională de fibrină și un conținut biologic bogat, format din trombocite, leucocite și factori de creștere eliberați gradual. În augmentare osoasă, această combinație contează deoarece regenerarea depinde de secvențe biologice care au nevoie de timp, de la stabilizarea inițială a cheagului până la angiogeneză și remodelare osoasă. O eliberare progresivă, la doze fiziologic relevante, susține mai bine aceste etape decât o expunere intensă și scurtă.
Diferențele față de PRP devin importante când ne uităm la calitatea matricei și la predictibilitate. PRF se obține fără anticoagulanți sau aditivi externi, ceea ce permite o polimerizare naturală a fibrinei. Rezultatul este o structură care poate funcționa ca schelă temporară pentru migrarea celulară și organizarea țesutului nou format. În același timp, prezența leucocitelor și a citokinelor contribuie la modularea răspunsului inflamator și la un echilibru biologic mai favorabil vindecării, aspect relevant atât pentru os, cât și pentru țesuturile moi adiacente.
Un alt punct care merită subliniat, mai ales în contextul augmentării osoase, este influența protocolului de preparare asupra rezultatului biologic final. Parametrii centrifugării pot schimba distribuția celulară, densitatea rețelei de fibrină și profilul de eliberare al factorilor de creștere. De aici apar, în practica clinică, diferențe observabile între o matrice care se comportă stabil, ușor de manevrat și integrabilă într-o strategie de grefa osoasa, și una care se degradează prea repede sau are o consistență dificil de controlat. În mod similar, detalii aparent „mici”, precum tipul de tub utilizat, pot influența calitatea cheagului și siguranța biologică a produsului final, motiv pentru care protocolul merită standardizat în cadrul fiecărei echipe.
În plan practic, PRF poate fi utilizat ca membrană sau sub formă injectabilă, în funcție de obiectivul clinic, iar valoarea sa crește atunci când este integrat într-un material de adiție de os. În combinație cu xenogrefe, PRF contribuie la crearea unui micro-mediu mai favorabil vascularizării și organizării tisulare, susținând maturarea treptată a osului nou format. Această logică explică de ce PRF a devenit o componentă frecventă în protocoalele moderne de augmentare, mai ales acolo unde se urmărește stabilitate biologică și o vindecare a țesuturilor moi care să protejeze zona augmentată.

Sursa foto: sciencedirect.com
PRF și xenogrefe în augmentare osoasă: raționament biologic și relevanță clinică
Utilizarea xenogrefelor în procedurile de augmentare osoasă este susținută de proprietățile lor osteoconductive și de capacitatea de a menține volumul în defectele osoase. Structura poroasă a acestor materiale oferă un suport stabil pentru depunerea osului nou, însă integrarea biologică depinde de vascularizarea rapidă a zonei și de inițierea proceselor de remodelare osoasă. În absența unor stimuli biologici intrinseci, aceste etape pot fi întârziate, influențând calitatea regenerării.
Asocierea PRF cu materiale de grefă osoasă xenogene răspunde acestei limitări biologice. PRF acționează ca o matrice tridimensională bioactivă, capabilă să rețină și să elibereze progresiv factori de creștere și citokine implicate în angiogeneză, migrarea celulară și osteogeneză. Studiile experimentale arată că integrarea PRF în biomateriale alogene, aloplastice și xenogene îmbunătățește proprietățile angiogenice și osteogenice ale acestora, fără efecte citotoxice. Din perspectivă clinică, acest lucru se traduce printr-un micro-mediu mai favorabil pentru inițierea regenerării osoase, în special în fazele timpurii ale vindecării.
Un mecanism important al acestei combinații este facilitarea aderenței și proliferării celulare pe suprafața particulelor de xenogrefă. Prin formarea unei interfețe biologice bogate în proteine și citokine, PRF susține organizarea matricei extracelulare și viabilitatea celulară. Eliberarea susținută de factori de creștere contribuie la angiogeneză persistentă, un element esențial pentru integrarea biologică a materialelor xenogene și pentru stabilitatea țesuturilor moi adiacente.
Datele disponibile indică faptul că beneficiile adăugării PRF sunt mai evidente în etapele inițiale ale regenerării osoase. Studiile in vivo și clinice descriu o accelerare a formării osului nou și o maturare mai rapidă a țesutului în primele săptămâni de vindecare, comparativ cu utilizarea xenogrefelor fără suport biologic. În etapele ulterioare, diferențele dintre zonele tratate cu și fără PRF tind să se atenueze, ceea ce sugerează că rolul PRF este legat în principal de optimizarea condițiilor biologice inițiale.
Rezultatele obținute prin combinarea PRF cu xenogrefe pot varia în funcție de protocolul utilizat și de modul de încorporare a PRF în materialul de grefă. Distribuirea uniformă a PRF în masa biomaterialului pare să prelungească efectele sale bioactive, prin constrângerile fizice impuse de schela de grefare. Această variabilitate evidențiază importanța standardizării protocoalelor și a unei înțelegeri clare a mecanismelor biologice care stau la baza regenerării, pentru obținerea unor rezultate predictibile în augmentarea osoasă.
Tocmai aceste aspecte, legate de raționamentul biologic, selecția materialelor și aplicarea clinică a PRF în asociere cu xenogrefe, stau la baza programelor de formare dedicate dezvoltate de 32Academy, orientate spre integrarea coerentă a suportului biologic în tehnicile moderne de augmentare osoasă.
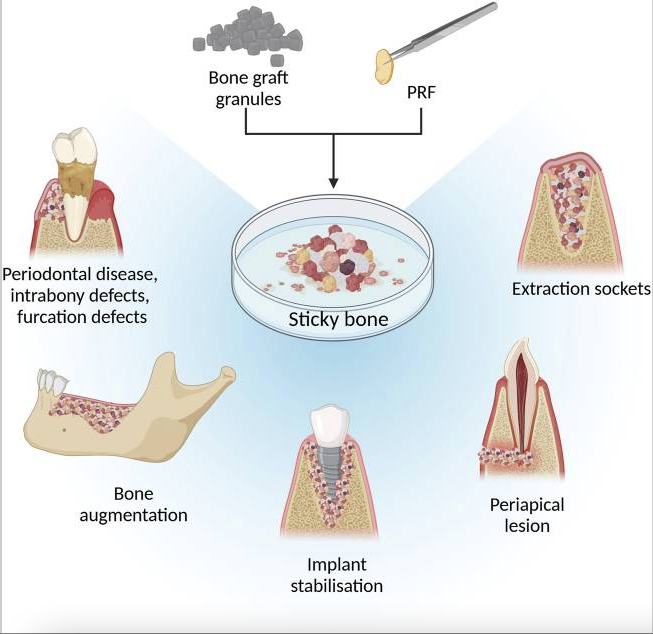
Sticky Bone: PRF lichid și xenogrefe în augmentarea osoasă modernă
Conceptul de Sticky Bone a apărut din nevoia de a combina stabilitatea mecanică a materialelor de grefă osoasă cu beneficiile biologice ale concentratelor plachetare. Sticky Bone desemnează un biomaterial moldabil, obținut prin amestecarea granulelor de substitut osos cu un concentrat plachetar, cel mai frecvent PRF, sub formă solidă, lichidă sau într-o combinație a acestora. Această asociere permite obținerea unui material coerent, ușor de modelat și adaptat morfologiei defectului, aspect deosebit de util în procedurile de augmentare osoasă care implică defecte neregulate sau volumetrice.
Structura gelatinoasă a PRF joacă un rol esențial în formarea Sticky Bone. Datorită rețelei de fibrină și a conținutului biologic activ, PRF poate fi fragmentat sau combinat cu PRF injectabil, rezultând un compozit care încorporează particulele de xenogrefe într-o masă stabilă. Această coeziune reduce riscul de migrare a particulelor de grefă și facilitează manipularea materialului în câmpul operator. În același timp, PRF contribuie la crearea unui micro-mediu biologic favorabil, prin eliberarea progresivă de factori de creștere și citokine implicate în angiogeneză și regenerare tisulară.
Din punct de vedere biologic, Sticky Bone acționează ca o schelă compozită, în care xenogrefele asigură suportul osteoconductiv, iar PRF optimizează integrarea biologică a materialului. Studiile experimentale și observațiile clinice arată că această combinație susține vascularizarea timpurie a zonei augmentate, îmbunătățește aderența și proliferarea celulară și favorizează organizarea matricei extracelulare. Aceste efecte sunt relevante mai ales în fazele inițiale ale vindecării, când stabilitatea biologică a grefei influențează evoluția ulterioară a regenerării osoase și a țesuturilor moi adiacente.
Utilizarea Sticky Bone este frecvent raportată în augmentările osoase complexe, unde controlul poziției materialului de grefă și adaptarea acestuia la defect sunt esențiale. Caracterul modelabil al compozitului permite o adaptare mai precisă la contururile defectului și o stabilizare mai bună a volumului augmentat. În plus, prezența PRF poate influența dinamica remodelării osoase, prin accelerarea proceselor biologice timpurii, chiar dacă diferențele față de grefele utilizate fără PRF pot deveni mai puțin evidente în etapele tardive ale vindecării.
Este important de subliniat că rezultatele obținute cu Sticky Bone depind de mai mulți factori, inclusiv tipul de PRF utilizat, modul de preparare și metoda de încorporare a acestuia în materialul de grefă osoasă. Variabilitatea protocoalelor explică diferențele raportate în literatură și evidențiază importanța standardizării și a unei înțelegeri corecte a principiilor biologice care stau la baza acestei tehnici. În practica clinică, Sticky Bone reprezintă o abordare care îmbină avantajele mecanice ale xenogrefelor cu potențialul biologic al PRF, oferind o soluție flexibilă pentru optimizarea rezultatelor în augmentarea osoasă.
Sursa foto: PMC11491360
PRF în augmentarea osoasă: indicații clinice și limite
Utilizarea PRF în procedurile de augmentare osoasă este justificată în special în situațiile în care regenerarea este influențată de vascularizare redusă, stabilitate biologică limitată sau vindecare lentă a țesuturilor moi. Asocierea PRF cu materiale de grefă osoasă, inclusiv cu xenogrefe, contribuie la optimizarea mediului biologic local și susține etapele timpurii ale regenerării, care influențează evoluția augmentării pe termen mediu.
PRF este frecvent utilizat în augmentările osoase care implică defecte moderate sau extinse, unde stabilizarea biologică a grefei și susținerea angiogenezei joacă un rol important. Prin eliberarea progresivă de factori de creștere și citokine, PRF favorizează migrarea celulară, organizarea matricei extracelulare și vindecarea țesuturilor moi adiacente. Aceste efecte sunt relevante mai ales în primele săptămâni postoperatorii, când integrarea biologică a materialului de grefă este esențială pentru stabilitatea augmentării.
În același timp, utilizarea PRF trebuie integrată într-o strategie regenerativă bine planificată. Eficiența clinică depinde de selecția corectă a indicației, de stabilitatea mecanică a grefei și de modul de aplicare a materialului. PRF acționează ca un suport biologic care optimizează procesele de vindecare, fără a înlocui rolul structural al materialelor de adiție de os sau principiile fundamentale ale tehnicilor de augmentare.
Literatura de specialitate evidențiază o variabilitate a rezultatelor, influențată de tipul de PRF utilizat, protocolul de preparare și metoda de încorporare în materialul de grefă. În multe situații, beneficiile PRF sunt mai vizibile în fazele inițiale ale vindecării, iar diferențele față de augmentările realizate fără PRF pot deveni mai puțin evidente în etapele tardive. Acest aspect subliniază importanța standardizării protocoalelor și a unei evaluări realiste a rezultatelor așteptate.
În practica clinică, integrarea PRF în augmentarea osoasă oferă un avantaj biologic atunci când este utilizată judicios, în corelație cu tipul defectului și cu obiectivele regenerative. Înțelegerea limitelor și a mecanismelor de acțiune permite clinicianului să folosească PRF și xenogrefele într-un mod predictibil, orientat spre calitatea regenerării și vindecarea țesuturilor moi.
În contextul actual al procedurilor de augmentare osoasă, utilizarea PRF în asociere cu materiale de adiție de os, în special cu xenogrefe, oferă un avantaj biologic clar în fazele timpurii ale regenerării. Prin susținerea vascularizării, recrutării celulare și organizării matricei extracelulare, PRF contribuie la o vindecare mai echilibrată a osului și a țesuturilor moi, influențând calitatea regenerării pe termen mediu. Eficiența clinică depinde însă de protocolul de preparare, de modul de integrare în grefa osoasă și de înțelegerea mecanismelor biologice implicate, aspecte care transformă PRF dintr-un simplu adjuvant într-un instrument predictibil atunci când este utilizat corect în strategiile moderne de augmentare osoasă.

Pentru medicii care doresc să aprofundeze utilizarea PRF în augmentarea osoasă și să înțeleagă aplicarea sa predictibilă în asociere cu xenogrefe, 32Academy pune la dispoziție cursul Augmentarea osoasă cu xenogrefe și PRF. Programul abordează atât fundamentele biologice ale matricelor PRF, cât și integrarea lor practică în tehnicile moderne de regenerare osoasă, inclusiv utilizarea PRF lichid și conceptele de tip sticky bone.
Cursul este susținut de Dr. Cleopatra Nacopoulos, cu experiență clinică extinsă în parodontologie, microchirurgie și implantologie orală, și oferă o perspectivă aplicată asupra protocoalelor de preparare, indicațiilor clinice și limitelor PRF în augmentarea osoasă. Accentul este pus pe decizia clinică informată și pe obținerea unor rezultate stabile, orientate spre calitatea regenerării și vindecarea țesuturilor moi.
Bibliografie: pmc.ncbi.nlm.nih.gov, sciencedirect.com


