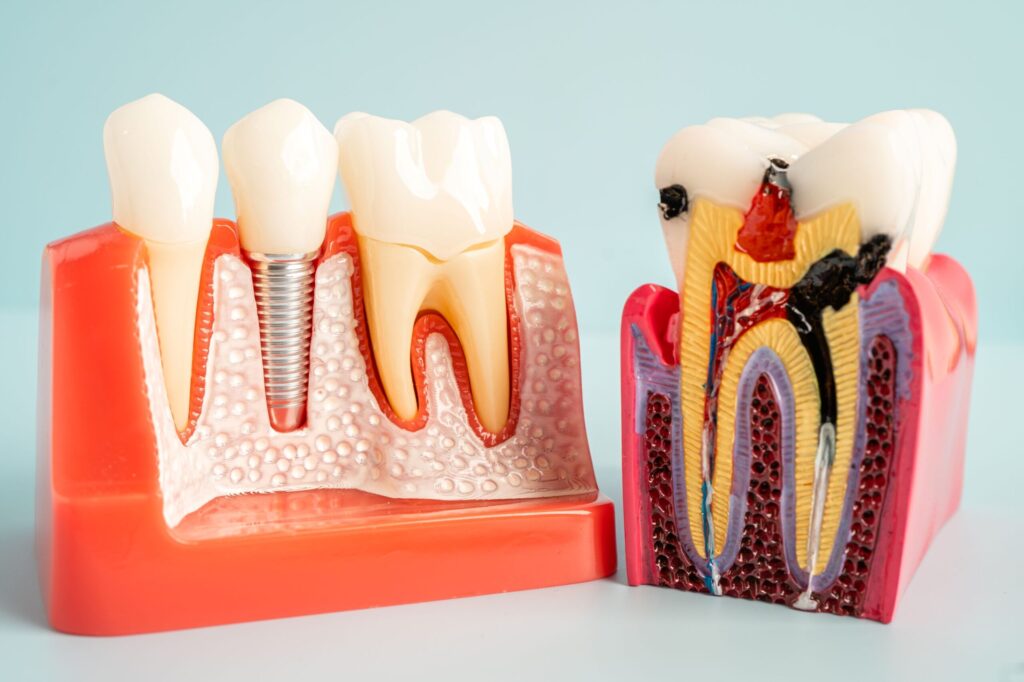
În ultimele decenii, medicii stomatologi au observat o schimbare uluitoare în implantologia dentară. În prezent, durata de viață a implantului dentar este previzibilă chiar și atunci când se confruntă cu diferențe în ceea ce privește cantitatea și calitatea osului, lungimea sau diametrul implantului și chiar și în ciuda diferitelor protocoale chirurgicale sau protetice.
Popularitatea acestei metode de tratare a edentației a crescut și datorită ratei de supraviețuire a implanturilor mai mare de 90-95% pe un termen de peste 5 ani. Se află în scădere constantă și rata complicațiilor, care inițial aveau loc în mai mult de 50% de cazuri. Însă, deoarece numărul implanturilor crește, numărul complicațiilor este și el în creștere.
Complicații în tratamentul periimplantar
Motivele pentru care un implant dentar eșuează sunt complicațiile, care pot fi mecanice și biologice, precoce și tardive. Conform statisticilor, cele mai des întâlnite sunt periimplantita și mucozita periimplantară, afectând în general între 20% și 50% pacienți.
De asemenea, există o serie de factori etiologici și de risc. Printre cei mai frecvenți sunt contaminarea tehnologică a suprafeței implantare, teoria stresului oxidativ, fenomenul micro-decalajului la nivelul conexiunii implant-bont, micro-mobilitatea la nivelul interfeței implant-bont, procese de hidroliză a aliajului de titan în organismul uman etc.
Suprafața implantului este un element crucial pentru reușita tratamentului, deoarece determină atașarea celulelor osoase și gingivale la implant. Suprafețele implanturilor dentare joacă un rol important în stabilitatea biologică a materialelor implantate și sunt supuse modificărilor pentru a îmbunătăți răspunsul țesutului gazdă-implant, ceea ce duce la un răspuns osos mai bun și la conservarea osului marginal.
Acest lucru poate explica creșterile observate în rata de supraviețuire a implantului de-a lungul anilor și predictibilitatea procedurilor de implant dentar, inclusiv plasarea și/sau încărcarea imediată. Cu toate acestea, chiar și cu îmbunătățiri ale suprafețelor implantului, s-a raportat că între 40% și 80% dintre toate eșecurile implantului apar în primele momente (la mai puțin de 6 luni de la implantare) și este necesară o mai bună înțelegere a acestor eșecuri.
Mai exact, prezența osului cu densitate scăzută (adică în maxilarul posterior) este o situație provocatoare care necesită o planificare adecvată a tratamentului implantar și protocoale chirurgicale, în plus față de o suprafață modificată a implantului pentru a diminua riscul de eșec al implantului.
Unele elemente, cum ar fi calciul, magneziul, zincul și stronțiul, au un rol relevant în unele procese moleculare și biochimice în timpul regenerării osoase și au fost investigate pe suprafețele implanturilor. Altele, cum ar fi cuprul, zincul, cobaltul și stronțiul, sunt cunoscute pentru efectele lor anabolice asupra metabolismului osos.
Titanul, biomaterialul preferat pentru implanturi dentare
O îmbunătățire continuă a tehnologiilor de tratare a suprafețelor a optimizat performanța și capacitatea implanturilor de a se osteointegra fie mai bine, fie chiar mai rapid. Mai mult, au fost propuse diferite tehnici de introducere a diverșilor ioni de metal exogeni pe suprafața implantului pentru a îmbunătăți osteointegrarea, dar și alți factori benefici includ rezistența crescută la coroziune, precum și proprietățile antiinflamatorii sau antibacteriene.
Datorită echilibrului biocompatibilității, proprietățile, rezistența la coroziune și capacitatea de osteointegrare, titanul (Ti) este considerat materialul preferat pentru aplicații biomedicale în ultimele decenii.
Cu toate acestea, utilizarea largă a titanului în domeniul medical a crescut, de asemenea, preocupările, cum ar fi efectele particulelor de titan liber eliberate în corpul uman și acumularea lor pe termen lung.
Este esențial să se conceapă pierderea osoasă aseptică ca un factor de risc pentru complicațiile biologice pe termen lung. Pierderea osoasă precoce (6 luni) poate pune în pericol stabilitatea osoasă și supraviețuirea implantului pe termen lung, iar rolul pierderii osoase precoce ca predictor pentru periimplantită a fost validat într-un studiu de cohortă prospectiv de 10 ani. Recent, a fost demonstrat că expunerea firului interproximal dictează stabilitatea osoasă pe termen lung a implanturilor. S-a ajuns la concluzia că chiar și un fir expus a implicat o creștere de 8 ori a riscului de periimplantită, iar fiecare fir suplimentar a adăugat un risc suplimentar de 4 ori mai mare. Din aceste motive, prevenirea pierderii aseptice osoase în jurul implanturilor este o prioritate cheie pentru medici.
Cu toate acestea, mulți alți factori care contribuie la metabolismul osos nu au fost încă explorați pe deplin. Întrucât pierderea osoasă marginală și periimplantita pot fi considerate afecțiuni cu o patogeneză complexă și multifactorială, acțiunea sinergică a mai multor dintre acești factori (implantare, chirurgicale, protetice, microbiologice și gazdă) poate fi necesară să depășească pragul individualizat al fiecărui pacient pentru apariția patologiei.
Unii autori au propus ca obiectivul unui tratament periimplantar să fie nu numai controlul plăcii bacteriene ci și evitarea sau minimizarea unui micromediu proinflamator în jurul implantului. O schimbare de paradigmă trebuie făcută pentru a evita diferențierea și activarea osteoclastelor cauzate de eliberarea locală sau sistemică a citokinelor proinflamatorii și a altor molecule. Această supraexpresie a mediatorilor inflamatori este generată nu numai odată cu colonizarea și activitatea bacteriilor patogene, ci și datorită altor factori precum prezența particulelor de titan, coroziunea, uzura, micromișcarea bontului, supraîncărcarea ocluzală și prezența resturilor de ciment.
Este important de subliniat că doar 28,8% din cazurile de periimplantită au fost considerate peri-induse pur de placa bacteriană, în timp ce 40,8% și 30,4% au fost considerate cazuri declanșate chirurgical și protetic. Într-adevăr, în unele cazuri, mai mulți factori de risc pot acționa sinergic și pot face dificilă găsirea factorului declanșator inițial.
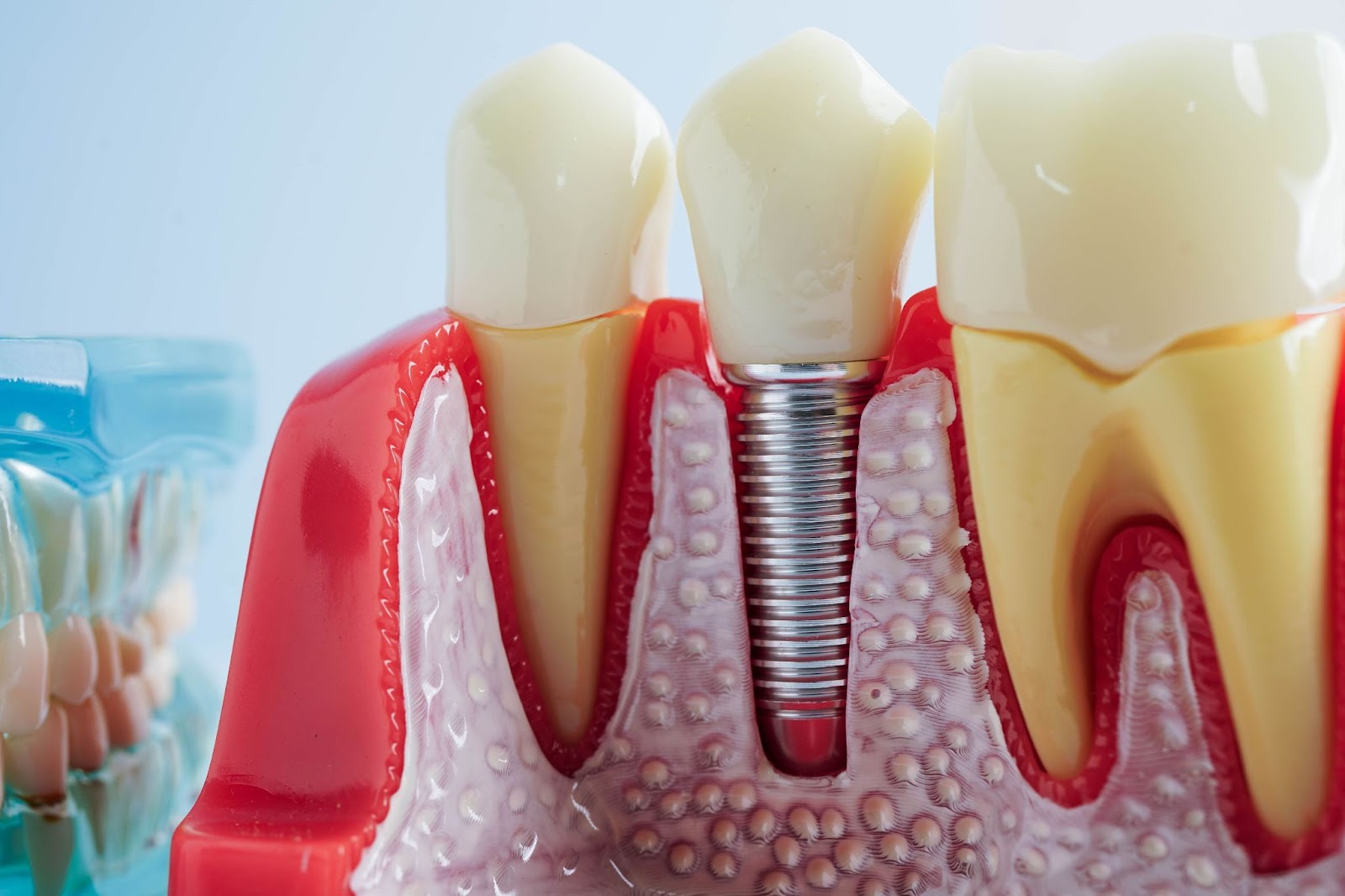
Cum afectează titanul metabolismul osos periimplantar
Imediat după implantare, suprafețele metalice externe sunt înconjurate de lichid extracelular și proteine. Apoi, se formează o peliculă densă de oxid pasiv pe o suprafață de titan în starea de oxidare. După expunerea titanului la oxigen, are loc pasivizarea spontană a suprafeței, ducând la formarea de TiO2 amorf sau slab cristalin de grosime 4–6 nm.
Acest strat oferă titanului toxicitate scăzută, reactivitate scăzută cu moleculele, solubilitate scăzută în apă, rezistență la coroziune și biocompatibilitate. În mod interesant, compoziția stratului proteic absorbit de pe suprafața implantului are o relevanță majoră pentru începutul și progresul răspunsului biologic după implantare.
De exemplu, unele acoperiri ale implanturilor dentare, cum ar fi pulverizarea cu plasmă atmosferică, induc formarea unui strat oxidat mai gros responsabil pentru o aderență mai mică a țesuturilor și un proces de osteogeneză mai lent. Straturi de oxid mai groase în jur de 100 nm le-ar îmbunătăți rezistența la coroziune, dar cu proprietăți biologice mai proaste. Prezența acestui strat de oxid de titan a fost considerată critică pentru prevenirea coroziunii miezului superficial și interior al implantului și pentru menținerea osteointegrării.
Cu toate acestea, prezența singulară nu este suficientă pentru a evita coroziunea din cauza mediilor complexe conținute în cavitatea bucală care afectează stabilitatea stratului de dioxid de titan prin mecanisme chimice sau mecanice, inclusiv uzura mecanică, coroziune și procese electrochimice.
Așadar, odată ce stratul de oxid protector este deteriorat, pot apărea modificări în compoziția chimică, aspectul suprafeței, rugozitatea și proprietățile mecanice. În acest moment, deteriorarea acestui strat induce eliberarea de particule de titan; osteointegrarea poate fi afectată, procesul de resorbție osoasă poate induce pierderea osoasă periimplantară și chiar ar putea apărea mucozită și periimplantită.
În acest sens este relevantă asocierea dintre testele de sensibilitate la TiO2 și apariția periimplantitei la pacienții cu cantități limitate de placă bacteriană. Acei pacienți ale căror celule macrofage au fost reactive la titan au avut un risc de 19 ori mai mare de a dezvolta periimplantită decât pacienții care nu au fost pozitivi la testul de sensibilitate. Pacienții testați pozitivi par să elibereze niveluri semnificativ mai mari de citokine după contactul cu TiO2, iar aceste niveluri crescute au fost asociate în mod semnificativ și independent cu eșecul implantului dentar din titan.
Influența designului implantului dentar
Factori precum suprafața implantului, compoziția implantului și a bontului sau tipul de conexiune pot fi relevanți pentru numărul de particule eliberate. Stabilitatea și etanșarea conexiunii implant-bont sunt cruciale. Mai multe procese pot induce deformare sau uzura conexiunii implantului, ceea ce duce la un microgap crescut, acumulare bacteriană sporită și diseminarea particulelor: conectarea și deconectarea repetată a bontului, grosimea redusă a pereților implantului, suprasarcina, diametrele înguste ale implantului sau ajustarea nepasivă a restaurării, printre altele, sunt toti factori critici.
O cercetare interesantă a demonstrat că implanturile cu diametru îngust cu conexiuni interne au prezentat leziuni la suprafață și eliberare de particule de titan după inserția în os artificial de tip II. Un implant a suferit o reducere a pereților interiori după inserție de 186,21 μm (inițial 655,89 μm ± 4,21μm; final 469.68 μm ± 27.6 μm). Aceste deformații majore în pereți și zgârieturi imediat după introducerea implantului dentar relevă una dintre principalele surse de eliberare a particulelor.
Un alt studiu care a testat implanturile conice Morse a raportat o deformare mai mică a peretelui și a sugerat inserarea implanturilor cu suporturi care se angajează în platforma implantului în loc de conexiunea implant-bont pentru a evita deteriorarea indusă de frecare. Conexiunile conice Morse pot evita uzura sub încărcare dacă caracteristicile anti-rotație nu sunt încorporate în corpul implantului.
Acest fapt ar putea să nu fie fezabil de implementat din cauza caracteristicilor intrinseci ale conexiunilor conice. Conexiunile conice pure au avut cea mai mare magnitudine de micro mișcare în comparație cu alte trei modele de conexiune; în termeni generali, în timp ce conexiunile cap la cap au tendința de a se uza, conexiunile conice tind să se rotească și frecarea are loc vertical cu deplasarea axială în implant.
În concluzie, nicio poziție perfectă a implantului nu este capabilă să evite unele micro mișcări la nivelul implant-bont. Într-un alt studiu, au fost măsurate micro mișcări de sarcină ciclică cu unghi de 30 de grade între 1,52 și 94,00 μm, în funcție de conexiune. Unele conexiuni conice Morse au prezentat micro mișcări de aproximativ 20–40 μm în timpul încărcării.
Din aceste motive, este de așteptat ca sarcina ocluzală a protezei implantului să favorizeze uzura între părțile conexiunii și odată ce oboseala apare și promovează deschiderea golului, se așteaptă ca particulele de metal să fie eliberate și împrăștiate în țesuturile vecine și în părțile interioare ale implanturilor colonizate de bacterii.

Evaluarea factorilor de risc ai bolii periimplantare
Bolile periimplantare sunt clasificate în mucozită periimplantară și periimplantită. Mucozita periimplantară este definită ca prezența unei inflamații limitată la țesuturile moi din jurul implantului dentar, fără semne de pierdere a osului de susținere. Pe de altă parte, periimplantita este caracterizată printr-un proces inflamator în jurul implantului, care include atât inflamarea țesuturilor moi, cât și pierderea progresivă a osului de susținere dincolo de remodelarea biologică.
Factorii etiologici ai bolii periimplantare includ flora bacteriană asemănătoare parodontozei (Porphyromonas gingivalis, Prevotella intermedia, Aggregatibacter actinomycetemcomitans etc.), factori biomecanici precum supraîncărcarea ocluzală, boli sistemice precum diabetul zaharat, factori sociali precum igiena orală deficitară și fumatul, obiceiurile parafuncționale precum bruxismul și factorii iatrogeni, cum ar fi lipsa stabilității primare și încărcarea prematură în timpul perioadei de vindecare.
Caracteristicile clinice ale bolilor peri-implantare includ sângerare la sondare, supurație, adâncime de sondare mai mare de 5 mm și pierderea osoasă progresivă dincolo de remodelare în cazurile de periimplantită. Pierderea osoasă normală așteptată este de aproximativ 2 mm postimplantare.
Au fost luați în considerare numeroși factori de risc în legătură cu bolile periimplantare, cum ar fi bolile parodontale anterioare și complianța pacientului, controlul plăcii, diabetul zaharat necontrolat, fumatul, caracteristicile implantului, suprasolicitarea ocluzală, cimentul rezidual, prezența mucoasei keratinizate și alte potențiali factori de risc emergenți.
S-a sugerat că acești factori de risc pot fi utilizați pentru a determina apariția bolilor periimplantare care ar putea duce, în consecință, la eșecul implantului.
În prezent, amploarea periimplantitei a crescut exponențial în comparație cu ultimul deceniu: anterior, în stadiile sale de îngrădire, ca fiind o modalitate de tratament viabilă, implanturile dentare puteau duce la eșec și la boli ulterioare într-un interval de 1-47%, care ulterior a crescut până la 85%.
Detectarea precoce a acestor posibili factori de risc, modificarea protocolului de tratament ori de câte ori este necesar împreună cu o urmărire regulată, pot asigura o rată de supraviețuire mai bună a implanturilor dentare. Au fost aplicate și încercate diferite instrumente de evaluare a riscurilor pentru pacienții aflați în terapia parodontală de susținere.
În concluzie, o asociere între biocoroziunea, prezența particulelor de titan și complicațiile implantului biologic a fost observată în multe studii de caz. Dar, până în prezent, nu există dovezi suficiente pentru a dovedi o relație cauzală unidirecțională.
Tocmai din cauza acestei lipse de dovezi, principiul prudenței trebuie să ne facă să fim extrem de atenți la factorii generatori de particule de titan pentru a evita inflamarea ulterioară în jurul implanturilor dentare. În cele din urmă, cercetările clinice pe această temă continuă și sunt necesare pentru a clarifica rolul exact al particulelor de titan în tratamentul periimplantar.
Bibliografie: National Library of Medicine (ncbi.nlm.nih.gov); onlinelibrary.wiley.com